

De krimpkracht van elke lengte van een eenheid op het oppervlak van de vloeistof wordt de oppervlaktespanning genoemd en de eenheid is N. · m-1.

De eigenschap van het verminderen van de oppervlaktespanning van het oplosmiddel wordt oppervlakteactiviteit genoemd en een stof met deze eigenschap wordt een oppervlakte-actieve stof genoemd.
De oppervlakte-actieve stof die moleculen in waterige oplossing kan binden en micellen en andere associaties kunnen vormen, en een hoge oppervlakte-activiteit heeft, terwijl ook het effect van bevochtiging, emulgerende, schuimen, wassen, enz. Op oppervlakteactieve stof wordt genoemd.
Oppervlakteactieve stof is organische verbindingen met een speciale structuur en eigenschap, die de grensvlakspanning tussen twee fasen of de oppervlaktespanning van vloeistoffen (in het algemeen water) aanzienlijk kunnen veranderen, met bevochtiging, schuimen, emulgerend, wassen en andere eigenschappen.
In termen van structuur hebben oppervlakteactieve stoffen een gemeenschappelijk kenmerk omdat ze twee groepen verschillende aard in hun moleculen bevatten. Aan de ene kant is een lange keten van niet-polaire groep, oplosbaar in olie en onoplosbaar in water, ook bekend als hydrofobe groep of waterafstotende groep. Een dergelijke waterafstotende groep is over het algemeen lange ketens van koolwaterstoffen, soms ook voor organische fluor, silicium, organofosfaat, organotineketen, enz. Aan de andere kant staat in water oplosbare groep, een hydrofiele groep of olie-repellente groep. De hydrofiele groep moet voldoende hydrofiel zijn om ervoor te zorgen dat volledige oppervlakteactieve stoffen oplosbaar zijn in water en de nodige oplosbaarheid heeft. Omdat oppervlakteactieve stoffen hydrofiele en hydrofobe groepen bevatten, kunnen ze in ten minste een van de vloeibare fasen oplosbaar zijn. Deze hydrofiele en lipofiele eigenschap van oppervlakteactieve stof wordt amfifiliciteit genoemd.


Oppervlakteactieve stof is een soort amfifiele moleculen met zowel hydrofobe als hydrofiele groepen. Hydrofobe groepen oppervlakteactieve stoffen zijn in het algemeen samengesteld uit koolwaterstoffen met lange ketens, zoals rechte keten alkyl C8 ~ C20, vertakte keten alkyl C8 ~ C20, alkylfenyl (alkyl carbon tom nummer is 8 ~ 16) en dergelijke. Het verschil dat klein is tussen hydrofobe groepen is voornamelijk in de structurele veranderingen van koolwaterstofketens. En de soorten hydrofiele groepen zijn meer, dus de eigenschappen van oppervlakteactieve stoffen zijn voornamelijk gerelateerd aan hydrofiele groepen naast de grootte en vorm van hydrofobe groepen. De structurele veranderingen van hydrofiele groepen zijn groter dan die van hydrofobe groepen, dus de classificatie van oppervlakteactieve stoffen is in het algemeen gebaseerd op de structuur van hydrofiele groepen. Deze classificatie is gebaseerd op de vraag of de hydrofiele groep ionisch is of niet, en deze is verdeeld in anionische, kationische, niet -ionische, zwitterionische en andere speciale soorten oppervlakteactieve stoffen.

① Adsorptie van oppervlakteactieve stoffen op de interfac
Oppervlakteactieve moleculen zijn amfifiele moleculen met zowel lipofiele als hydrofiele groepen. Wanneer de oppervlakteactieve stof in water wordt opgelost, wordt de hydrofiele groep aangetrokken tot water en lost op in water, terwijl de lipofiele groep wordt afgestoten door water en water achterlaat, wat resulteert in de adsorptie van oppervlakteactieve moleculen (of ionen) op het interface van de twee fasen, die de interfaciale tensie tussen de twee fasen vermindert. Hoe meer oppervlakteactieve moleculen (of ionen) worden geadsorbeerd op het interface, hoe groter de vermindering van de grensvlakspanning.
② Enkele eigenschappen van adsorptiemembraan
Oppervlaktedruk van adsorptiemembraan: adsorptie van oppervlakteactieve stof op de gas-vloeistofinterface om een adsorptiemembraan te vormen, zoals plaats een wrijvingsloos verwijderbaar drijvende plaat op het interface, duwt het drijvende plaat het adsorberende membraan langs het oplossingoppervlak en het membraan genereert een druk op het drijvende plaat, die oppervlaktedruk wordt genoemd.
Viscositeit van het oppervlak: Net als oppervlaktedruk is oppervlakteviscositeit een eigenschap die wordt getoond door onoplosbaar moleculair membraan. Opgehangen door een platinaring met een fijne metalen draad, zodat het vlak in contact komt met het wateroppervlak van de tank, roteer de platinaling, de platinaring door de viscositeit van de waterhinder, de amplitude vervalt geleidelijk, volgens welke de viscositeit van het oppervlak kan worden gemeten. De methode is: Ten eerste wordt het experiment uitgevoerd op het zuivere wateroppervlak om het amplitude -verval te meten, en vervolgens wordt het verval na de vorming van het oppervlaktemembraan gemeten en wordt de viscositeit van het oppervlaktemembraan afgeleid van het verschil tussen de twee.
De viscositeit van het oppervlak is nauw verwant aan de stevigheid van het oppervlaktemembraan, en aangezien het adsorptiemembraan oppervlaktedruk en viscositeit heeft, moet het elasticiteit hebben. Hoe hoger de oppervlaktedruk en hoe hoger de viscositeit van het geadsorbeerde membraan, hoe hoger de elastische modulus. De elastische modulus van het oppervlakte -adsorptiemembraan is belangrijk in het proces van bellenstabilisatie.
③ Vorming van micellen
Verdunde oplossingen van oppervlakteactieve stoffen gehoorzamen de wetten gevolgd door ideale oplossingen. De hoeveelheid oppervlakteactieve stof geadsorbeerd op het oppervlak van de oplossing neemt toe met de concentratie van de oplossing, en wanneer de concentratie een bepaalde waarde bereikt of overschrijdt, neemt de hoeveelheid adsorptie niet langer toe, en deze overtollige oppervlakteactieve moleculen zijn op een lukrakende manier of op een of andere regelmatige manier. Zowel praktijk als theorie laten zien dat ze associaties vormen in oplossing, en deze associaties worden micellen genoemd.
Kritische micelconcentratie (CMC): de minimale concentratie waarbij oppervlakteactieve stoffen micellen vormen in oplossing wordt de kritische micelconcentratie genoemd.
④ CMC -waarden van gemeenschappelijke oppervlakteactieve stoffen.

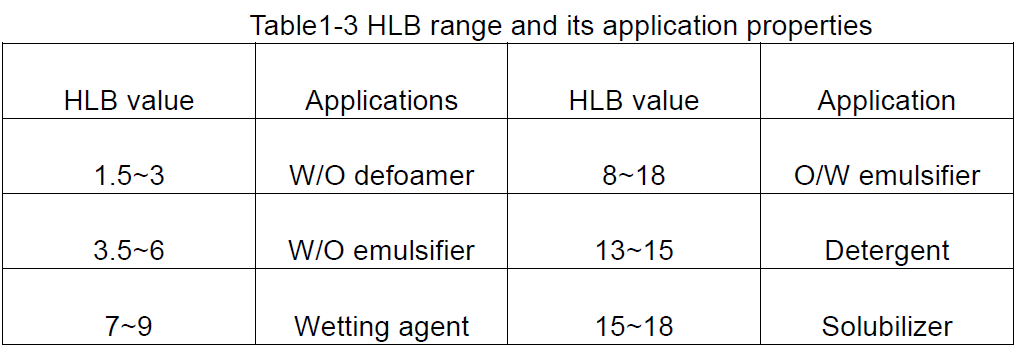
HLB is de afkorting van hydrofiele lipofiele balans, die de hydrofiele en lipofiele balans van de hydrofiele en lipofiele groepen van de oppervlakteactieve stof aangeeft, dwz de HLB -waarde van de oppervlakteactieve stof. Een grote HLB -waarde duidt op een molecuul met sterke hydrofiliciteit en zwakke lipofiliciteit; Omgekeerd, sterke lipofiliciteit en zwakke hydrofiliciteit.
① bepalingen van HLB -waarde
De HLB-waarde is een relatieve waarde, dus wanneer de HLB-waarde wordt ontwikkeld, is de HLB-waarde van paraffine wax, die geen hydrofiele eigenschappen heeft, is gespecificeerd als 0, terwijl de HLB-waarde van natriumdodecylsulfaat, die meer water oplevert, is 40. 10 zijn lipofiel, terwijl die groter dan 10 hydrofiel zijn. Het keerpunt van lipofiel naar hydrofiel is dus ongeveer 10.
Op basis van de HLB-waarden van oppervlakteactieve stoffen kan een algemeen idee van hun mogelijke gebruik worden verkregen, zoals weergegeven in tabel 1-3.

Twee wederzijds onoplosbare vloeistoffen, de ene in de andere verspreid als deeltjes (druppeltjes of vloeibare kristallen) een systeem vormen dat een emulsie wordt genoemd. Dit systeem is thermodynamisch onstabiel vanwege de toename van het grensoppervlak van de twee vloeistoffen wanneer de emulsie wordt gevormd. Om de emulsie stabiel te maken, is het noodzakelijk om een derde component toe te voegen - emulgator om de grensvlakergie van het systeem te verminderen. Emulgator behoort tot oppervlakteactieve stof, de belangrijkste functie is om de rol van emulsie te spelen. De fase van de emulsie die bestaat als druppeltjes wordt de gedispergeerde fase (of binnenfase, discontinue fase) genoemd, en de andere fase die aan elkaar is gekoppeld, wordt het dispersiemedium (of buitenste fase, continue fase) genoemd.
① emulgatoren en emulsies
Gemeenschappelijke emulsies, één fase is water- of waterige oplossing, de andere fase is organische stoffen die niet mengbaar zijn met water, zoals vet, was, enz. De emulsie gevormd door water en olie kan worden verdeeld in twee typen volgens hun dispersiesituatie: oliedispersie in water om olie-in-water type emulsie te vormen, uitgedrukt als o/w (olie/water): water-in-water-type emulsie, uitgedrukt als oliedype), uitgedrukt als o/w (olie/water): water-in-water-type emulsie, uitgedrukt als oliedype). Complexe water-in-olie-in-water W/O/W-type en olie-in-water-in-olie O/W/W-type multi-emulsies kunnen ook worden gevormd.
Emulgatoren worden gebruikt om emulsies te stabiliseren door de grensvlakspanning te verminderen en een interfaciaal membraan met één molecuul te vormen.
In de emulgering van de emulgatiereisen:
A: De emulgator moet de interface tussen de twee fasen kunnen adsorberen of verrijken, zodat de grensvlakspanning wordt verminderd;
B: De emulgator moet de deeltjes aan de lading geven, zodat elektrostatische afstoting tussen de deeltjes, of een stabiel, zeer viskeus beschermend membraan rond de deeltjes vormt.
Daarom moet de substantie die als emulgator wordt gebruikt amfifiele groepen hebben om te emulgeren, en oppervlakteactieve stoffen kunnen aan deze vereiste voldoen.
② Bereidingsmethoden van emulsies en factoren die de stabiliteit van emulsies beïnvloeden
Er zijn twee manieren om emulsies te bereiden: een is om de mechanische methode te gebruiken om de vloeistof te verspreiden in kleine deeltjes in een andere vloeistof, die meestal in de industrie wordt gebruikt om emulsies te bereiden; De andere is om de vloeistof op te lossen in een moleculaire toestand in een andere vloeistof en deze vervolgens goed te laten verzamelen om emulsies te vormen.
De stabiliteit van een emulsie is het vermogen tot anti-deeltjesaggregatie die leidt tot fasescheiding. Emulsies zijn thermodynamisch onstabiele systemen met grote vrije energie. Daarom is de zogenaamde stabiliteit van een emulsie eigenlijk de tijd die het systeem nodig heeft om evenwicht te bereiken, dwz de tijd die nodig is voor scheiding van een van de vloeistoffen in het systeem.
Wanneer het grensvlakmembraan met vetalcoholen, vetzuren en vette amines en andere polaire organische moleculen, membraansterkte aanzienlijk hoger. Dit komt omdat, in de grensvlakadsorptielaag van emulgiermoleculen en alcoholen, zuren en amines en andere polaire moleculen om een "complex" te vormen, zodat de grensvlakmembraansterkte toenam.
Emulgatoren bestaande uit meer dan twee oppervlakteactieve stoffen worden gemengde emulgatoren genoemd. Gemengde emulgator geadsorbeerd op de water-/olie -interface; Intermoleculaire werking kan complexen vormen. Vanwege de sterke intermoleculaire werking wordt de grensvlakspanning aanzienlijk verminderd, de hoeveelheid emulgator geadsorbeerd op het interface is aanzienlijk verhoogd, de vorming van grensvlakmembraandichtheid neemt toe, de sterkte neemt toe.
De lading van de vloeibare kralen heeft een significant effect op de stabiliteit van de emulsie. Stabiele emulsies, waarvan de vloeibare kralen over het algemeen worden geladen. Wanneer een ionische emulgator wordt gebruikt, heeft het emulgierion geadsorbeerd op het grensvlak zijn lipofiele groep ingebracht in de oliefase en de hydrofiele groep bevindt zich in de waterfase, waardoor de vloeibare kralen worden geladen. Terwijl de emulsieparels met dezelfde lading elkaar afstoten, stoten ze elkaar af, niet gemakkelijk te agglomereren, zodat de stabiliteit wordt verhoogd. Het is te zien dat hoe meer emulgatorionen ionen op de kralen geadsorbeerd, hoe groter de lading, hoe groter het vermogen om te voorkomen dat de kralen van agglomeratie, hoe stabieler het emulsiesysteem.
De viscositeit van het emulsiedispersiemedium heeft een zekere invloed op de stabiliteit van de emulsie. Over het algemeen geldt dat hoe hoger de viscositeit van het dispersiemedium, hoe hoger de stabiliteit van de emulsie. Dit komt omdat de viscositeit van het dispersiemedium groot is, wat een sterk effect heeft op de Brownse beweging van de vloeibare kralen en de botsing tussen de vloeibare kralen vertraagt, zodat het systeem stabiel blijft. Gewoonlijk kunnen de polymeerstoffen die in emulsies kunnen worden opgelost, de viscositeit van het systeem verhogen en de stabiliteit van emulsies hoger maken. Bovendien kunnen polymeren ook een sterk grensvlakmembraan vormen, waardoor het emulsiesysteem stabieler wordt.
In sommige gevallen kan de toevoeging van vast poeder ook ervoor zorgen dat de emulsie stabiliseert. Vast poeder bevindt zich in het water, olie of grensvlak, afhankelijk van de olie, water op het bevochtigingsvermogen van het vaste poeder, als het vaste poeder niet volledig nat is met water, maar ook nat door olie, blijft op het water- en olie -interface.
Het vaste poeder maakt de emulsie niet stabiel omdat het poeder dat op het grensvlak is verzameld, het grensvlakmembraan verbetert, dat vergelijkbaar is met de grensvlakadsorptie van emulgiermoleculen, dus hoe beter het vaste poedermateriaal op het interface is gerangschikt, hoe stabieler de emulsie is.
Oppervlakteactieve stoffen hebben het vermogen om de oplosbaarheid van onoplosbare of enigszins in water oplosbare organische stoffen aanzienlijk te vergroten na het vormen van micellen in waterige oplossing, en de oplossing is op dit moment transparant. Dit effect van de micel wordt solubilisatie genoemd. De oppervlakteactieve stof die oplosmiddel kan produceren, wordt solubilisator genoemd en de organische materie die wordt opgelost, wordt opgeloste materie genoemd.

Schuim speelt een belangrijke rol in het wasproces. Schuim is een dispersiesysteem waarbij een gas wordt gedispergeerd in een vloeistof of vaste stof, met het gas als de gedispergeerde fase en de vloeistof of vaste stof als het verspreidingsmedium, de eerste wordt vloeibaar schuim genoemd, terwijl de laatste vast schuim wordt genoemd, zoals geschuimd plastic, geschuimd glas, schuimcement etc.
(1) Schuimvorming
Met schuim bedoelen we hier een aggregaat van luchtbellen gescheiden door een vloeibaar membraan. Dit type bel stijgt altijd snel naar het vloeibare oppervlak vanwege het grote verschil in dichtheid tussen de gedispergeerde fase (GAS) en het dispersiemedium (vloeistof), gecombineerd met de lage viscositeit van de vloeistof.
Het proces van het vormen van een bel is om een grote hoeveelheid gas in de vloeistof te brengen, en de bubbels in de vloeistof keren snel terug naar het oppervlak, waardoor een aggregaat van bubbels wordt gescheiden door een kleine hoeveelheid vloeibaar gas.
Schuim heeft twee significante kenmerken in termen van morfologie: een daarvan is dat de bubbels als een verspreide fase vaak polyedraal van vorm zijn, dit komt omdat er op het snijvlak van de bellen een neiging is voor de vloeibare film om te dunnen zodat de bubbels polyedraal worden, wanneer de vloeibare film grijpt tot een bepaalde mate, het leidt tot bubbelbeurt; De tweede is dat pure vloeistoffen geen stabiel schuim kunnen vormen, de vloeistof die schuim kan vormen, is ten minste twee of meer componenten. Waterige oplossingen van oppervlakteactieve stoffen zijn typerend voor systemen die vatbaar zijn voor het genereren van schuim, en hun vermogen om schuim te genereren is ook gerelateerd aan andere eigenschappen.
Oppervlakteactieve stoffen met een goede schuimvermogen worden schuimmiddelen genoemd. Hoewel het schuimmiddel een goed schuimvermogen heeft, maar het gevormde schuim kan misschien niet lang handhaven, dat wil zeggen dat de stabiliteit niet noodzakelijk goed is. Om de stabiliteit van het schuim te handhaven, vaak in het schuimmiddel om stoffen toe te voegen die de stabiliteit van het schuim kunnen vergroten, wordt de stof schuimstabilisator genoemd, vaak gebruikt stabilisator is laurynl diethanolamine en dodecyldimethylamineoxide.
(2) stabiliteit van het schuim
Schuim is een thermodynamisch onstabiel systeem en de uiteindelijke trend is dat het totale oppervlak van de vloeistof in het systeem afneemt nadat de bel is verbroken en de vrije energie afneemt. Het defoamingproces is het proces waardoor het vloeibare membraan dat het gas scheidt dikker en dunner wordt totdat het breekt. Daarom wordt de mate van stabiliteit van het schuim voornamelijk bepaald door de snelheid van vloeistofafvoer en de sterkte van de vloeibare film. De volgende factoren beïnvloeden dit ook.
(3) schuimvernietiging
Het basisprincipe van schuimvernietiging is om de omstandigheden te veranderen die het schuim produceren of om de stabiliserende factoren van het schuim te elimineren, dus zijn er zowel fysische als chemische methoden voor het onvoldoende.
Fysieke defoaming betekent het veranderen van de omstandigheden van de schuimproductie met behoud van de chemische samenstelling van de schuimoplossing, zoals externe storingen, veranderingen in temperatuur of druk en ultrasone behandeling zijn allemaal effectieve fysische methoden om schuim te elimineren.
De chemische defoaming -methode is om bepaalde stoffen toe te voegen om te interageren met het schuimmiddel om de sterkte van de vloeibare film in het schuim te verminderen en dus de stabiliteit van het schuim te verminderen om het doel van het onvoldoende te bereiken, dergelijke stoffen worden defoamers genoemd. De meeste defoamers zijn oppervlakteactieve stoffen. Daarom moet Defoamer volgens het mechanisme van defoaming een sterk vermogen hebben om de oppervlaktespanning te verminderen, gemakkelijk te adsorberen op het oppervlak, en de interactie tussen de oppervlakte -adsorptiemoleculen is zwak, adsorptiemoleculen die zijn gerangschikt in een meer loien structuur.
Er zijn verschillende soorten defoamer, maar in principe zijn het allemaal niet-ionische oppervlakteactieve stoffen. Niet-ionische oppervlakteactieve stoffen hebben anti-foaming-eigenschappen in de buurt van of boven hun wolkenpunt en worden vaak gebruikt als defoamers. Alcoholen, vooral alcoholen met een vertakkingsstructuur, vetzuren en vetzuuresters, polyamiden, fosfaatesters, siliconenoliën, enz. Worden ook vaak gebruikt als uitstekende defoamers.
(4) Schuim en wassen
Er is geen direct verband tussen schuim en het wassen van de effectiviteit en de hoeveelheid schuim duidt niet op de effectiviteit van de wasbeurt. Niet -ionische oppervlakteactieve stoffen hebben bijvoorbeeld veel minder schuimende eigenschappen dan zeep, maar hun decontaminatie is veel beter dan zeep.
In sommige gevallen kan schuim nuttig zijn bij het verwijderen van vuil en vuil. Bij het wassen van schalen in het huis pakt het schuim van het wasmiddel bijvoorbeeld de oliedruppeltjes op en bij het schrobben van tapijten helpt het schuim om stof, poeder en ander vast vuil op te pakken. Bovendien kan schuim soms worden gebruikt als een indicatie van de effectiviteit van een wasmiddel. Omdat vette oliën een remmend effect hebben op het schuim van het wasmiddel, wanneer er te veel olie en te weinig wasmiddel is, zal er geen schuim worden gegenereerd of zal het oorspronkelijke schuim verdwijnen. Schuim kan soms ook worden gebruikt als een indicator voor de netheid van een spoeling, omdat de hoeveelheid schuim in de spoeloplossing de neiging heeft om af te nemen met de vermindering van wasmiddel, zodat de hoeveelheid schuim kan worden gebruikt om de spoelgraad te evalueren.
In brede zin is wassen het proces van het verwijderen van ongewenste componenten uit het object dat moet worden gewassen en een doel te bereiken. Wassen in de gebruikelijke zin verwijst naar het proces van het verwijderen van vuil uit het oppervlak van de drager. Tijdens wassen wordt de interactie tussen het vuil en de drager verzwakt of geëlimineerd door de werking van sommige chemische stoffen (bijv. Deterier, enz.), Zodat de combinatie van vuil en drager wordt veranderd in de combinatie van vuil en wasmiddel, en ten slotte is het vuil gescheiden van de drager. Omdat de te wassen objecten moeten worden gewassen en het te verwijderen vuil divers is, is wassen een zeer complex proces en kan het basisproces van wassen worden uitgedrukt in de volgende eenvoudige relaties.
Carrie ·· vuil + wasmiddel = drager + vuil · wasmiddel
Het wasproces kan meestal worden verdeeld in twee fasen: ten eerste, onder de actie van het wasmiddel, wordt het vuil gescheiden van zijn drager; Ten tweede is het vrijstaande vuil verspreid en opgeschort in het medium. Het wasproces is een omkeerbaar proces en het vuil verspreid en gesuspendeerd in het medium kan ook opnieuw worden geprecipiteerd van het medium naar het gewassen object. Daarom moet een goed wasmiddel de mogelijkheid hebben om vuil te verspreiden en op te schorten en opnieuw aflossingen van vuil te voorkomen, naast het vermogen om vuil van de drager te verwijderen.
(1) soorten vuil
Zelfs voor hetzelfde item kunnen het type, de samenstelling en de hoeveelheid vuil variëren, afhankelijk van de omgeving waarin het wordt gebruikt. Oliebody vuil is voornamelijk enkele dierlijke en plantaardige oliën en minerale oliën (zoals ruwe olie, stookolie, koolteer, enz.), Vast vuil is voornamelijk roet, as, roest, koolstof zwart, enz. In termen van kleding vuil, is er vuil uit het menselijk lichaam, zoals zweet, sebum, bloed, enz.; vuil van voedsel, zoals fruitvlekken, kookolie vlekken, specerijen, zetmeel, enz.; vuil van cosmetica, zoals lippenstift, nagellak, enz.; vuil uit de atmosfeer, zoals roet, stof, modder, enz.; Anderen, zoals inkt, thee, coating, enz. Het komt in verschillende soorten.
De verschillende soorten vuil kunnen meestal worden verdeeld in drie hoofdcategorieën: vast vuil, vloeibaar vuil en speciaal vuil.
① vast vuil
Gewoon vast vuil omvat deeltjes van as, modder, aarde, roest en koolstof zwart. De meeste van deze deeltjes hebben een elektrische lading op hun oppervlak, de meeste zijn negatief geladen en kunnen gemakkelijk worden geadsorbeerd op vezelartikelen. Vast vuil is over het algemeen moeilijk op te lossen in water, maar kan worden verspreid en gesuspendeerd door wasmiddeloplossingen. Vast vuil met een kleiner massapunt is moeilijker te verwijderen.
② vloeibaar vuil
Vloeibaar vuil is meestal in olie oplosbaar, inclusief planten- en dierlijke oliën, vetzuren, vetalcoholen, minerale oliën en hun oxiden. Onder hen kunnen planten- en dierlijke oliën, vetzuren en alkali -veressificatie optreden, terwijl vetalcoholen, minerale oliën niet worden verzeilend door alkali, maar kunnen oplosbaar zijn in alcoholen, ethers en organische oplosmiddelen voor koolwaterstof en emulsificatie en dispersie van wasmiddelwateroplossing. Olieoplosbaar vloeibaar vuil heeft over het algemeen een sterke kracht met vezelartikelen en is steviger geadsorbeerd op vezels.
③ Speciaal vuil
Speciaal vuil omvat eiwitten, zetmeel, bloed, menselijke secreties zoals zweet, talg, urine en vruchtensap en theesap. Het grootste deel van dit type vuil kan chemisch en sterk worden geadsorbeerd op vezelartikelen. Daarom is het moeilijk om te wassen.
De verschillende soorten vuil worden zelden alleen gevonden, maar worden vaak gemengd en geadsorbeerd op het object. Vuil kan soms worden geoxideerd, ontbonden of vervallen onder externe invloeden, waardoor nieuw vuil wordt gecreëerd.
(2) Hechting van vuil
Kleding, handen etc. kunnen worden gekleurd omdat er een soort interactie is tussen het object en het vuil. Vuil houdt zich op verschillende manieren aan objecten, maar er zijn niet meer dan fysische en chemische verklevingen.
De hechting van roet, stof, modder, zand en houtskool aan kleding is een fysieke hechting. Over het algemeen is de verwijdering van vuil ook door deze hechting van vuil en de rol tussen het gekleurde object relatief zwak. Volgens de verschillende krachten kan de fysieke hechting van vuil worden onderverdeeld in mechanische adhesie en elektrostatische adhesie.
A: Mechanische hechting
Dit type hechting verwijst voornamelijk naar de hechting van wat massief vuil (bijv. Stof, modder en zand). Mechanische adhesie is een van de zwakkere vormen van hechting van vuil en kan bijna worden verwijderd door puur mechanische middelen, maar wanneer het vuil klein is (<0,1um), is het moeilijker te verwijderen.
B : Elektrostatische hechting
Elektrostatische hechting wordt voornamelijk gemanifesteerd in de werking van geladen vuildeeltjes op tegengesteld geladen objecten. De meeste vezelachtige objecten zijn negatief geladen in water en kunnen gemakkelijk worden nageleefd door bepaald positief geladen vuil, zoals kalktypen. Sommige vuil, hoewel negatief geladen, zoals zwarte zwarte deeltjes in waterige oplossingen, kunnen zich aan vezels hechten door ionische bruggen (ionen tussen meerdere tegengesteld geladen objecten, samen met hen op een brugachtige manier) gevormd door positieve ionen in water (bijv. Ca2+, mg2+ enz.).
Elektrostatische werking is sterker dan eenvoudige mechanische werking, waardoor het verwijderen van vuil relatief moeilijk is.
② Chemische hechting
Chemische hechting verwijst naar het fenomeen van vuil dat op een object werkt door chemische of waterstofbruggen. Bijvoorbeeld, polaire vast vuil, eiwitten, roest en andere hechting op vezelartikelen, vezels bevatten carboxyl, hydroxyl, amide en andere groepen, deze groepen en olieachtige vuilvetzuren, vetalcoholen zijn gemakkelijk te vormen waterstofbruggen. De chemische krachten zijn over het algemeen sterk en het vuil is daarom steviger gebonden aan het object. Dit type vuil is moeilijk te verwijderen volgens de gebruikelijke methoden en vereist speciale methoden om ermee om te gaan.
De mate van hechting van vuil is gerelateerd aan de aard van het vuil zelf en de aard van het object waaraan het wordt nageleefd. Over het algemeen hechten deeltjes zich gemakkelijk aan vezelige items. Hoe kleiner de textuur van het vaste vuil, hoe sterker de hechting. Polair vuil op hydrofiele objecten zoals katoen en glas heinen sterker dan niet-polair vuil. Niet-polair vuil hecht sterker dan polair vuil, zoals polaire vetten, stof en klei, en is minder eenvoudig te verwijderen en schoon te maken.
(3) MECHTISME VERWIJDEREN
Het doel van wassen is om vuil te verwijderen. In een medium van een bepaalde temperatuur (voornamelijk water). Het gebruik van de verschillende fysische en chemische effecten van het wasmiddel om het effect van vuil en gewassen objecten te verzwakken of te elimineren, onder werking van bepaalde mechanische krachten (zoals handwrijven, wasmachine -agitatie, watereffect), zodat het vuil en gewassen objecten vanuit het doel van ontsmetting.
① mechanisme van vloeistof vuil verwijdering
A: bevochtiging
Vloeistofvuiling is meestal op olie gebaseerd. Olievlekken nat de meeste vezelachtige items en verspreiden zich min of meer als een oliefilm op het oppervlak van het vezelachtige materiaal. De eerste stap in de wasactie is het bevochtigen van het oppervlak door de wasvloeistof. Ter illustratie kan het oppervlak van een vezel worden beschouwd als een glad vast oppervlak.
B: Olie -detachement - Curling -mechanisme
De tweede stap in de wasactie is het verwijderen van olie en vet, het verwijderen van vloeibaar vuil wordt bereikt door een soort coiling. Het vloeibare vuil bestond oorspronkelijk op het oppervlak in de vorm van een gespreide oliefilm, en onder het preferentiële bevochtigingseffect van de wasvloeistof op het vaste oppervlak (dwz het vezeloppervlak), krulde het stap voor stap op in oliaralen, die werden vervangen door de wasvloeistof en uiteindelijk het oppervlak onder bepaalde externe krachten.
② mechanisme van solide vuilverwijdering
De verwijdering van vloeibaar vuil is voornamelijk door de preferentiële bevochtiging van de vuildrager door de wasoplossing, terwijl het verwijderingsmechanisme voor vast vuil anders is, waar het wasproces voornamelijk gaat over het bevochtigen van de vuilmassa en zijn drageroppervlak door de wasoplossing. Vanwege de adsorptie van oppervlakteactieve stoffen op het vaste vuil en zijn drageroppervlak, wordt de interactie tussen het vuil en het oppervlak verminderd en wordt de hechtsterkte van de vuilmassa op het oppervlak verminderd, dus wordt de vuilmassa gemakkelijk verwijderd uit het oppervlak van de drager.
Bovendien heeft de adsorptie van oppervlakteactieve stoffen, met name ionische oppervlakteactieve stoffen, op het oppervlak van het vaste vuil en zijn drager het potentieel om het oppervlaktepotentiaal op het oppervlak van het vaste vuil en zijn drager te vergroten, die bevorderlijker is voor het verwijderen van het vuil. Vaste of over het algemeen vezelachtige oppervlakken zijn meestal negatief geladen in waterige media en kunnen daarom diffuse dubbele elektronische lagen op vuilmassa's of vaste oppervlakken vormen. Vanwege de afstoting van homogene ladingen is de hechting van vuildeeltjes in het water aan het vaste oppervlak verzwakt. Wanneer een anionische oppervlakteactieve stof wordt toegevoegd, omdat deze tegelijkertijd het negatieve oppervlaktepotentieel van het vuildeeltje en het vaste oppervlak kan vergroten, is de afstoting daartussen verbeterd, de hechtsterkte van het deeltje is meer verminderd en is het vuil gemakkelijker te verwijderen.
Niet-ionische oppervlakteactieve stoffen worden geadsorbeerd op algemeen geladen vaste oppervlakken en hoewel ze het grensvlakpotentieel niet significant veranderen, hebben de geadsorbeerde niet-ionenoppervlakteactieve stoffen de neiging om een bepaalde dikte van geadsorbeerde laag op het oppervlak te vormen die helpt om hervosing van vuil te voorkomen.
In het geval van kationogene oppervlakteactieve stoffen vermindert of elimineert hun adsorptie het negatieve oppervlaktepotentiaal van de vuilmassa en het drageroppervlak, dat de afstoting tussen het vuil en het oppervlak vermindert en daarom niet bevorderlijk is voor vuilverwijdering; Bovendien hebben kationogene oppervlakteactieve stoffen na adsorptie op het vaste oppervlak de neiging om het vaste oppervlak hydrofoob te worden en zijn daarom niet bevorderlijk voor het bevochtigen van het oppervlak en daarom wassen.
③ Verwijdering van speciale bodems
Eiwitten, zetmeel, menselijke secreties, vruchtensap, theesap en ander dergelijk vuil zijn moeilijk te verwijderen met normale oppervlakteactieve stoffen en vereisen een speciale behandeling.
Eiwitvlekken zoals room, eieren, bloed, melk en huiduitscheiding hebben de neiging om de vezels en degeneratie te coaguleren en een sterkere hechting te krijgen. Eiwitvuiling kan worden verwijderd met behulp van proteasen. Het enzymprotease breekt de eiwitten in het vuil af in in water oplosbare aminozuren of oligopeptiden.
Zetmeelvlekken komen voornamelijk uit levensmiddelen, anderen zoals jus, lijm enz. Amylase heeft een katalytisch effect op de hydrolyse van zetmeelvlekken, waardoor zetmeel in suikers afbreekt.
Lipase katalyseert de ontleding van triglyceriden, die moeilijk te verwijderen zijn door normale methoden, zoals talg en eetbare oliën, en breekt ze af in oplosbare glycerol en vetzuren.
Sommige gekleurde vlekken van vruchtensappen, theesappen, inkten, lippenstift enz. Zijn vaak moeilijk te reinigen, zelfs na herhaald wassen. Deze vlekken kunnen worden verwijderd door een redoxreactie met een oxiderende of reductiemiddel zoals bleekmiddel, dat de structuur van de kleurgenererende of kleur-auxiliaire groepen vernietigt en deze in kleinere in water oplosbare componenten afbreekt.
(4) Vlekverwijderingsmechanisme van stomerij
Het bovenstaande is eigenlijk voor water als het wasmedium van wassen. Vanwege de verschillende soorten kleding en structuur is sommige kleding die water wassen met water wassen niet handig of niet gemakkelijk te wassen, wat kleding na wassen en zelfs vervorming, vervaging, enz. Bijvoorbeeld: de meeste natuurlijke vezels absorberen water en absorberen gemakkelijk en gemakkelijk te zwellen, droog en gemakkelijk te verkleinen, dus na het wassen zal worden vervormd; Door wolproducten te wassen, verschijnen ook vaak krimpfenomeen, sommige wollen producten met water wassen zijn ook gemakkelijk te pilen, kleurverandering; Sommige handgevoel van zijde wordt erger na het wassen en verliezen hun glans. Gebruik voor deze kleding vaak de droogreinigingsmethode om te ontsmetten. De zogenaamde stomerij verwijst in het algemeen naar de wasmethode in organische oplosmiddelen, vooral in niet-polaire oplosmiddelen.
Stomme reiniging is een zachtere vorm van wassen dan water wassen. Omdat stomerij niet veel mechanische werking vereist, veroorzaakt dit geen schade, rimpels en vervorming aan kleding, terwijl stomerijen, in tegenstelling tot water, zelden expansie en samentrekking produceren. Zolang de technologie correct wordt afgehandeld, kan de kleding stom worden schoongemaakt zonder vervorming, kleurvervaging en verlengde levensduur.
In termen van stomerij zijn er drie brede soorten vuil.
①Oil oplosbaar door vuil olie oplosbaar vuil omvat allerlei olie en vet, die vloeibaar of vet is en kan worden opgelost in stomerijoplosmiddelen.
② in water oplosbaar door vuil in water oplosbaar vuil is oplosbaar in waterige oplossingen, maar niet in droogreinigingsmiddelen, wordt geadsorbeerd op kleding in een waterige toestand, water verdampt na de neerslag van korrelige vaste stoffen, zoals anorganische zouten, zetmeel, eiwitten, enz.
③Oil en water onoplosbare vuilolie en in water onoplosbaar vuil is noch oplosbaar in water noch oplosbaar in stomerij oplosmiddelen, zoals koolstofzwart, silicaten van verschillende metalen en oxiden, enz.
Vanwege de verschillende aard van verschillende soorten vuil zijn er verschillende manieren om vuil te verwijderen in het droogreinigingsproces. Olieoplosbare bodems, zoals oliën en plantaardige oliën, minerale oliën en vetten, zijn gemakkelijk oplosbaar in organische oplosmiddelen en kunnen gemakkelijker worden verwijderd bij stomerij. De uitstekende oplosbaarheid van droogrezende oplosmiddelen voor oliën en vetten komt in wezen uit de Van der Walls-krachten tussen moleculen.
Voor het verwijderen van in water oplosbaar vuil, zoals anorganische zouten, suikers, eiwitten en zweet, moet de juiste hoeveelheid water ook worden toegevoegd aan het droogreinigingsmiddel, anders is in water oplosbaar vuil moeilijk uit de kleding te verwijderen. Water is echter moeilijk op te lossen in het droogreinigingsmiddel, dus om de hoeveelheid water te vergroten, moet u ook oppervlakteactieve stoffen toevoegen. De aanwezigheid van water in het droogreinigingsmiddel kan het oppervlak van het vuil en de kleding gehydrateerd maken, zodat het gemakkelijk is om te interageren met de polaire groepen oppervlakteactieve stoffen, die bevorderlijk zijn voor de adsorptie van oppervlakteactieve stoffen op het oppervlak. Wanneer oppervlakteactieve stoffen micellen vormen, kunnen bovendien in water oplosbaar vuil en water worden opgelost in de micellen. Naast het vergroten van het watergehalte van het droogreinigingsoplosmiddel, kunnen oppervlakteactieve stoffen ook een rol spelen bij het voorkomen van de herafzetting van vuil om het ontsmettingeffect te verbeteren.
De aanwezigheid van een kleine hoeveelheid water is nodig om in water oplosbaar vuil te verwijderen, maar te veel water kan vervorming en rimpels veroorzaken in sommige kleding, dus de hoeveelheid water in het droogreinigingsmiddel moet matig zijn.
Vuil dat noch in water oplosbaar is, noch in olie oplosbare, vaste deeltjes zoals as, modder, aarde en koolstofzwart, wordt in het algemeen aan het kledingstuk bevestigd door elektrostatische krachten of in combinatie met olie. Bij droogreiniging kan de stroming van oplosmiddel, impact de elektrostatische krachtadsorptie van vuil eraf maken, en het droogreinigingsmiddel kan de olie oplossen, zodat de combinatie van olie en vuil en bevestigd aan de kleding van vaste deeltjes in de droge reinigingsmiddel, droge reinigingsmiddel in een kleine hoeveelheid water- en oppervlakte-deeltjes van het kledingstukken, om te voorkomen dat het kleding is, om te voorkomen.
(5) Factoren die de wasactie beïnvloeden
De directionele adsorptie van oppervlakteactieve stoffen op het grensvlak en de reductie van oppervlakte (grensvlak) spanning zijn de belangrijkste factoren bij het verwijderen van vloeibaar of vast vuil. Het wasproces is echter complex en het waseffect, zelfs met hetzelfde wasmiddeltype, wordt beïnvloed door vele andere factoren. Deze factoren omvatten de concentratie van het wasmiddel, de temperatuur, de aard van het vervuiling, het type vezel en de structuur van de stof.
① concentratie oppervlakteactieve stoffen
De micellen van oppervlakteactieve stoffen in oplossing spelen een belangrijke rol in het wasproces. Wanneer de concentratie de kritische micelconcentratie (CMC) bereikt, neemt het waseffect sterk toe. Daarom moet de concentratie van wasmiddel in het oplosmiddel hoger zijn dan de CMC -waarde om een goed waseffect te hebben. Wanneer de concentratie van oppervlakteactieve stof echter hoger is dan de CMC -waarde, is de incrementele toename van het waseffect niet duidelijk en is het niet nodig om de concentratie van oppervlakteactieve stof te veel te vergroten.
Bij het verwijderen van olie door solubilisatie neemt het solubilisatie -effect toe met de toenemende concentratie van de oppervlakteactieve stof, zelfs wanneer de concentratie boven CMC is. Op dit moment is het raadzaam om wasmiddel op een lokale gecentraliseerde manier te gebruiken. Als er bijvoorbeeld veel vuil op de manchetten en kraag van een kledingstuk is, kan een laag wasmiddel worden toegepast tijdens het wassen om het oplosbare effect van de oppervlakteactieve stof op de olie te vergroten.
②Temperatuur heeft een zeer belangrijke invloed op de decontaminatieactie. Over het algemeen vergemakkelijkt het verhogen van de temperatuur het verwijderen van vuil, maar soms kan een te hoge temperatuur ook nadelen veroorzaken.
De temperatuurstijging vergemakkelijkt de diffusie van vuil, vast vet wordt gemakkelijk geëmulgeerd bij temperaturen boven het smeltpunt en de vezels stijgen in zwelling als gevolg van de toename van de temperatuur, die allemaal de verwijdering van vuil vergemakkelijken. Voor compacte stoffen worden de microgaps tussen de vezels echter verminderd naarmate de vezels uitzetten, wat schadelijk is voor het verwijderen van vuil.
Temperatuurveranderingen beïnvloeden ook de oplosbaarheid, de CMC -waarde en de micelgrootte van oppervlakteactieve stoffen, waardoor het waseffect wordt beïnvloed. De oplosbaarheid van oppervlakteactieve stoffen met lange koolstofketens is laag bij lage temperaturen en soms is de oplosbaarheid zelfs lager dan de CMC -waarde, dus de wastemperatuur moet op de juiste manier worden verhoogd. Het effect van temperatuur op de CMC-waarde en de micelgrootte is verschillend voor ionische en niet-ionische oppervlakteactieve stoffen. Voor ionische oppervlakteactieve stoffen verhoogt een temperatuurstijging in het algemeen de CMC -waarde en vermindert de micelgrootte, wat betekent dat de concentratie van oppervlakteactieve stof in de wasoplossing moet worden verhoogd. Voor niet-ionische oppervlakteactieve stoffen leidt een temperatuurstijging tot een daling van de CMC-waarde en een significante toename van het micelvolume, dus het is duidelijk dat een geschikte temperatuurstijging de niet-ionische oppervlakteactieve stof zal helpen om zijn oppervlakteactieve effect uit te oefenen. De temperatuur mag echter niet hoger zijn dan zijn wolkenpunt.
Kortom, de optimale wastemperatuur hangt af van de wasmiddelformulering en het object dat wordt gewassen. Sommige wasmiddelen hebben een goed wasmiddeleffect bij kamertemperatuur, terwijl anderen een veel andere wasmiddelen hebben tussen koude en warm wassen.
③ schuim
Het is gebruikelijk om schuimend vermogen te verwarren met waseffect, in de overtuiging dat wasmiddelen met een hoog schuimvermogen een goed waseffect hebben. Onderzoek heeft aangetoond dat er geen directe relatie is tussen het waseffect en de hoeveelheid schuim. Wassen met lage schuimende wasmiddelen is bijvoorbeeld niet minder effectief dan wassen met hoge schuimende wasmiddelen.
Hoewel schuim niet direct gerelateerd is aan wassen, zijn er gelegenheden waarin het bijvoorbeeld helpt om vuil te verwijderen bij het wassen van afwas met de hand. Bij het schrobben van tapijten kan schuim ook stof en andere vaste vuildeeltjes wegnemen, tapijtvuil is goed voor een groot deel van het stof, dus tapijtreinigingsmiddelen moeten een bepaald schuimvermogen hebben.
Schuimkracht is ook belangrijk voor shampoos, waarbij het fijne schuim die door de vloeistof wordt geproduceerd tijdens het shampooen of baden, het haar gesmeerd en comfortabel aanvoelt.
④ Variëteiten van vezels en fysieke eigenschappen van textiel
Naast de chemische structuur van de vezels, die de hechting en verwijdering van vuil beïnvloeden, hebben het uiterlijk van de vezels en de organisatie van het garen en de stof invloed op het gemak van vuilverwijdering.
De schalen van wollen vezels en de gebogen platte linten van katoenvezels hebben meer kans om vuil te verzamelen dan gladde vezels. Koolstof zwart gekleurd op cellulosefilms (viscose -films) is bijvoorbeeld gemakkelijk te verwijderen, terwijl koolstof zwart gekleurd op katoenen stoffen moeilijk te wassen is. Een ander voorbeeld is dat korte-vezelstoffen van polyester meer vatbaar zijn voor het verzamelen van olievlekken dan stoffen met lange vezels, en olievlekken op korte vezelstoffen zijn ook moeilijker te verwijderen dan olievlekken op stoffen met lange vezel.
Strak gedraaide garens en strakke stoffen, vanwege de kleine opening tussen de vezels, kunnen de invasie van vuil weerstaan, maar hetzelfde kan ook voorkomen dat de wasvloeistof het interne vuil uitsluit, dus strakke stoffen beginnen zich te weerstaan om vuil goed te weerstaan, maar eenmaal bevlekte wassen is ook moeilijker.
⑤ Hardheid van water
De concentratie van Ca2+, Mg2+ en andere metaalionen in het water heeft een grote invloed op het waseffect, vooral wanneer de anionische oppervlakteactieve stoffen Ca2+ en Mg2+ -ionen tegenkomen die calcium- en magnesiumzouten vormen die minder oplosbaar zijn en de wasmiddel zullen verminderen. In hard water, zelfs als de concentratie van oppervlakteactieve stof hoog is, is de wasgentie nog steeds veel erger dan bij destillatie. Voor de oppervlakteactieve stof om het beste waseffect te hebben, moet de concentratie van Ca2+ -ionen in het water worden gereduceerd tot 1 x 10-6 mol/L (CACO3 tot 0,1 mg/L) of minder. Dit vereist de toevoeging van verschillende verzachters aan het wasmiddel.
Posttijd: februari-25-2022



